Insuline : sa physiologie et l’histoire de l’insulinothérapie
L’année 2021 marque le centenaire de la découverte de l’insuline. Il y a tout juste un siècle a commencé l’histoire de l’insulinothérapie, et cet événement majeur a révolutionné le pronostic du diabète. Le développement de l’insulinothérapie permet désormais aux personnes avec un diabète de mener une vie quasi-normale. Dans le but de diminuer la lourde charge mentale des personnes avec un diabète (de type 1 particulièrement), de leur permettre de consacrer moins de temps à la gestion de leur maladie chronique et donc plus de temps à ce qui compte pour elles, les dernières innovations permettent même d’automatiser et de personnaliser la délivrance d’insuline (appareils de mesure, etc.).
Apprenez-en plus avec nous sur l’insuline, sa physiologie, mais aussi les principales découvertes et innovations qui ont jalonné l’histoire de l’insulinothérapie.
Physiologie de l’insuline
Chez les personnes qui n’ont pas de diabète
Qu’est-ce l’insuline ?
L’insuline est une hormone secrétée par les cellules bêta du pancréas.
Toutes les cellules productrices d’hormones (ou cellules endocrines), sont regroupées en îlots de Langerhans qui représentent 2% de la masse du pancréas. Les cellules β (bêta) de l’îlot fabriquent ainsi de l’insuline qui est produite initialement sous la forme de pro-insuline. Selon les besoins, la pro-insuline se divise en deux :
- le peptide C,
- l’insuline : libérée dans le sang, elle agit principalement sur le foie, les muscles et le tissu adipeux.
En plus des cellules β, l’îlot comporte les cellules :
- ⍺ (alpha) → glucagon,
- δ (oméga) → somatostatine,
- PP → polypeptide pancréatique.
La fonction de l’insuline
Chez les personnes n’ayant pas de diabète, l’ingestion d’aliments lors d’un repas (et en particulier de glucides), s’accompagne d’une élévation de la concentration de glucose dans le sang (glycémie), qui va activer la sécrétion d’insuline très rapidement au niveau des cellules β des îlots de Langerhans.
Une fois sécrétée, l’insuline fait entrer le glucose du sang dans les cellules, pour produire de l’énergie, ce qui va être alors à l’origine d’une baisse de la glycémie.
Dans le foie, l’insuline favorise la mise en réserve du glucose sous forme de glycogène, mais aussi la fabrication des protéines dans les muscles et le stockage des graisses dans le tissu adipeux.
| LE SAVIEZ-VOUS ?
> L’insuline est la seule hormone de l’organisme à action hypoglycémiante (diminuant le taux de glucose dans le sang)1. > L’insuline est en moyenne le 6ème liquide le plus cher au monde, devant le mercure ou encore le sang humain, et coûte plus de 2 000 euros le litre2. |
D’autres hormones, hyperglycémiantes cette fois, interviennent dans le maintien de la glycémie, dont le glucagon, qui lui est sécrété par les cellules ⍺ des îlots en cas de baisse du taux de sucre dans le sang.
Grâce à la modulation de l’action de ces hormones suivant le niveau glycémique, la glycémie pourra être maintenue dans la fourchette de valeurs considérées comme normales. Chez les personnes qui ne sont pas atteintes de diabète, son taux doit être compris entre 0,7 et 1,10 g/l de sang à jeun.
Si l’insuline est sécrétée en grande quantité au moment des repas, elle est également nécessaire pour assurer le métabolisme de base de l’organisme (fonctionnement de base hors repas).
Chez les personnes vivant avec un diabète : action de l’insuline perturbée
Pour les personnes avec un diabète, la régulation de la sécrétion d’insuline et donc son action sur le métabolisme est perturbée :
- Dans le diabète de type 1, il y a une absence complète de sécrétion d’insuline.
- Dans le diabète de type 2, la phase initiale de sécrétion d’insuline est altérée si bien que l’insuline secrétée ne suffit pas à ramener la glycémie dans les valeurs souhaitées et celle-ci va rester élevée, en particulier après les repas.
En cas d’absence ou d’insuffisance d’insuline, l’organisme ne peut plus utiliser son « carburant » habituel (le glucose) qui ne peut, de ce fait, plus pénétrer dans les cellules.
L’organisme doit donc utiliser ses « carburants » de réserve : les graisses et les protéines. Pour cela, le tissu adipeux mobilise ses réserves (triglycérides, acides gras et glycérol), et les muscles dégradent leurs protéines (acides aminés). Le foie dégrade rapidement ses réserves de glycogène en glucose, et capte les acides aminés et le glycérol, pour les transformer en glucose. Il capte aussi les acides gras, et les transforme en corps cétoniques, qui sont libérés dans le sang.
Les muscles ne captent plus de glucose, et une élévation de la glycémie se développe (hyperglycémie). Si la carence en insuline est importante et durable, on observera alors, non seulement une élévation du taux de sucre dans le sang, mais aussi la présence de corps cétoniques dans le sang et l’apparition également de glucose et de corps cétoniques dans les urines.
Histoire de l’insulinothérapie : un parcours jalonné de découvertes majeures
Les prémices de l’insuline synthétique : une origine animale
Les premières insulines étaient extraites et purifiées à partir de pancréas de porc et de vache. On parlait alors d’insuline « ordinaire », administrée en 3 ou 4 injections par jour, à l’aide de seringues en verre à stériliser, d’aiguilles de taille conséquente, et la préparation devait être conservée au réfrigérateur.
Dans les années 1930-50, divers procédés ont permis d’obtenir des formes “d’action prolongée” de l’insuline, utilisée en flacon et avec des seringues. Cette insuline était toutefois imparfaitement purifiée. Les impuretés étaient responsables d’allergies ou réactions locales aux sites d’injection ; on notait également des lipodystrophies plus fréquentes et la production d’anticorps anti-insuline, à l’origine d’une efficacité moindre de l’insuline.
Dans les années 1970, l’élimination de ces impuretés donne des insulines animales « purifiées » par chromatographie, appelées Monopic ou Monocomposées. On parle alors « d’insuline hautement purifiée ».
Reproduction de l’insuline humaine grâce à un procédé chimique
La structure chimique et physiologie de l’insuline humaine sont décrites en 1955 par le biochimiste F. Sanger.
Dans les années 1980, l’insuline animale est remplacée par l’équivalent de l’insuline humaine. Elle est obtenue par transformation de l’insuline de porc par procédé chimique (hémisynthèse), puis par fabrication par génie génétique (biosynthèse), à partir de bactéries ou levures. L’intérêt ? Identique à l’insuline humaine, cette innovation majeure permet de ne plus dépendre d’une source animale, de diminuer le risque de formation d’anticorps, et surtout de disposer de quantités illimitées d’insuline.
Les analogues de l’insuline
Dans les années 1990, la modification de la composition de l’insuline de synthèse change sa vitesse et sa durée d’action. On parle d’insulines modifiées ou « analogues de l’insuline », produites par biosynthèse. On distingue :
- Les « analogues rapides » : début d’action rapide et durée d’action courte, par rapport à l’insuline humaine
- Les « analogues d’action prolongée » : insuline intermédiaire ou lente
En 1993, les résultats du Diabetes Control and Complications Trial (DCCT) sont révélés : ainsi réduire l’hyperglycémie chronique jugée sur le niveau d’HbA1c permet de prévenir les complications à long terme du diabète de type 1 (rétine, reins, nerfs). Ces résultats plaident donc pour la nécessité d’obtenir un bon contrôle glycémique.
C’est le début des traitements insuliniques « intensifiés par multi-injections ». Le concept d’éducation thérapeutique, qui vise à fournir aux personnes avec un diabète les outils pour gérer leur maladie chronique, s’impose de plus en plus dans la prise en charge (mesure du glucose, etc.).
Actuellement, toutes les insulines sont produites par génie génétique, médicament recombinant. Elles ont exactement la même composition que l’insuline humaine ou, dans le cas des « analogues » de l’insuline, une composition modifiée pour raccourcir ou allonger la durée d’action. Selon leur durée d’action et la rapidité d’apparition de leur action, on distingue trois formes d’insuline :
- Lente (plus de 24 heures)
- Intermédiaire (12 heures)
- Rapide (2 à 4 heures)
Histoire de l’insulinothérapie : des solutions innovantes
Appareils de gestion du diabète : pompes à insuline, stylos à insuline et lecteurs de glycémie
Dans les années 80, la pompe à insuline fait son apparition. Elle libère en permanence de l’insuline dans l’organisme, et mime ainsi les fonctions du pancréas d’une personne qui n’a pas de diabète de type 1.
Dans le même temps, les premiers stylos à cartouche d’insuline permettent de limiter le recours aux seringues et flacons. Ils sont suivis par les seringues pré-remplies jetables d’insuline, un moyen plus simple de s’injecter de l’insuline appelé communément « stylo à insuline ». Tournant dans l’histoire de l’insulinothérapie : c’est la fin des seringues en verre et des aiguilles réutilisées, stérilisées à l’eau bouillante.
Par ailleurs, les premiers lecteurs de glycémie capillaire se miniaturisent, deviennent de plus en plus sophistiqués et n’ont besoin que de minuscules gouttes de sang pour fonctionner. La fiabilité du taux de sucre mesuré dans le sang est accrue.
Mesure du glucose en continu
L’automesure glycémique fait également un grand pas en avant dans l’histoire de l’insulinothérapie avec l’apparition des premiers dispositifs de mesure du glucose en continu (MGC) et qui permet le contrôle quasi instantané et pluriquotidien du taux de glucose interstitiel, au plus près des valeurs de la glycémie capillaire.
Outils et techniques : qu’en est-il aujourd’hui ?
Les personnes vivant avec un diabète (diabète de type 1 majoritairement) s’administrent leur dose d’insuline par voie sous-cutanée. Elles utilisent, en fonction du mode d’action :
- Une insuline de vie à action prolongée, lente ou intermédiaire pour couvrir les besoins insuliniques de base
- Une insuline à action rapide et brève, pour les repas
L’association d’insuline lente et rapide permet de se rapprocher de la physiologie de l’insuline dans l’organisme et vise à maintenir le taux de sucre proche de la normale.
Les « analogues » d’insuline rapide, autorisent un temps plus réduit entre l’injection et le repas, surtout hors du domicile (restaurant, cantine, restauration rapide). Cela a permis le développement de « l’insulinothérapie fonctionnelle » ou « carbohydrate counting » des anglo-saxons, basée sur une estimation de la dose de l’insuline du repas, en fonction de la quantité de glucides ingérée. Une durée d’action plus courte diminue le risque d’hypoglycémies à distance du repas, ou en cas de cumul de doses, entre deux repas.
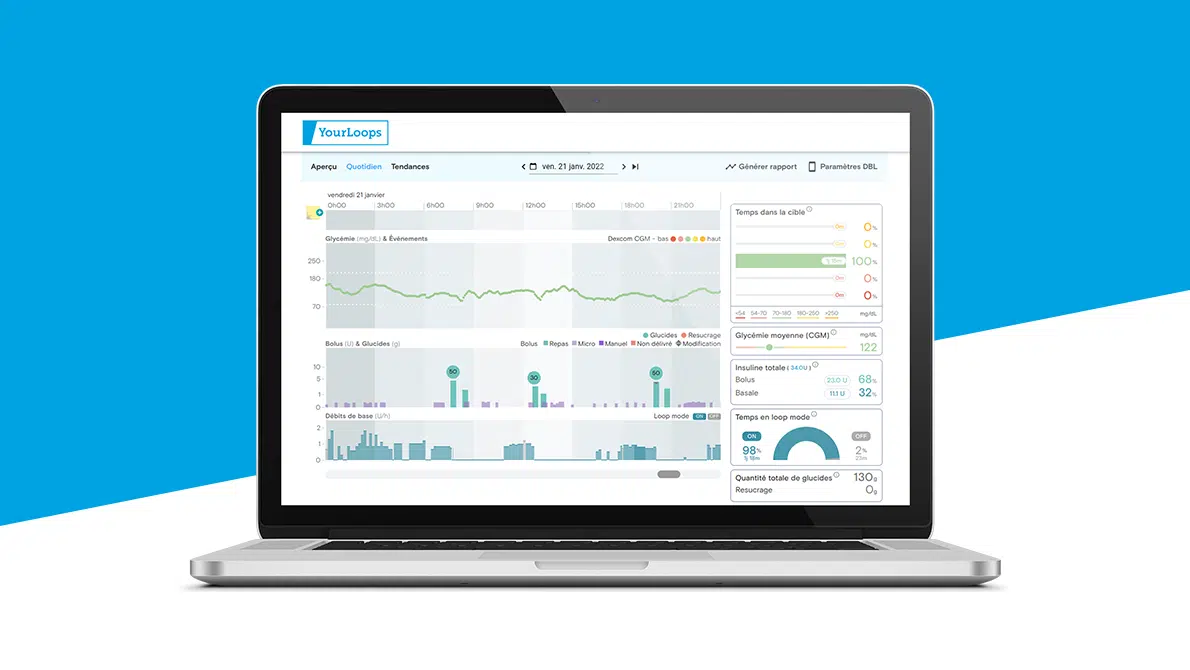
L’usage des pompes à insuline sous cutanée, qui n’utilisent que de l’insuline rapide, bénéficie grandement des nouvelles insulines plus rapides et plus courtes, surtout dans la perspective des systèmes automatisés de délivrance d’insuline (aussi appelés « boucle fermée » ou « boucle semi-fermée ») qui connectent :
- Un algorithme d’aide à la prise de décision
- Un capteur de mesure du glucose en continu (MGC)
- Une pompe à insuline
La délivrance d’insuline est alors automatisée et ajustée en fonction des valeurs glycémiques transmises par la solution de mesure du glucose en continu.
Dans certains cas précis, l’apport d’insuline par une greffe d’îlots de Langerhans est également envisagé dans des centres spécialisés.3, 4, 5, 6